IXCHIQMC a démontré un profil d’innocuité généralement bien toléré
Le profil d’innocuité et de tolérabilité d’IXCHIQMC a été évalué dans le cadre de trois études cliniques randomisées et multicentriques1* .
Les données sur l’innocuité d’IXCHIQMC présentées ci-dessous ont été recueillies chez 4115 participants à l’étude clinique principale VLA1553–301, randomisés selon un rapport 3:1 pour recevoir IXCHIQMC ou un placebo. Au total, 3082 adultes en santé âgés de 18 à 88 ans ont reçu une seule dose d’IXCHIQMC et 1033 ont reçu le placebo (solution saline tamponnée au phosphate). Les participants ont fait l’objet d’un suivi pour l’innocuité pendant 6 mois après la vaccination1.
Effets indésirables (EI) systémiques et au point d’injection sollicités survenus dans les 10 jours suivant une vaccination unique (population évaluée sur l’innocuité dans l’étude VLA1553–301)1

Tous les effets indésirables sollicités survenus au point d’injection ont été classés comme légers ou modérés, à l’exception d’un seul, à savoir une douleur classée comme sévère dans le groupe IXCHIQMC.
Les effets indésirables locaux et systémiques ont disparu dans un délai médian de 2 jours1.
Fréquence des effets indésirables semblables au chikungunya
- Dans l’étude VLA1553‑301, les participants ont été surveillés pour un ensemble de symptômes correspondant à ceux d’une infection au chikungunya de type sauvage1.
- Les effets indésirables semblables au chikungunya ont été définis selon les critères suivants1 :
- Fièvre (≥ 38 °C)
- Un ou plusieurs des symptômes suivants : arthralgie ou arthrite, myalgie, céphalées, maux de dos, éruptions cutanées, lymphadénopathie, ou certains symptômes neurologiques, cardiaques ou oculaires apparus dans les 30 jours suivant la vaccination, qu’ils soient simultanés ou non.
- Les symptômes graves semblables au chikungunya sont ceux empêchant toute activité quotidienne et/ou nécessitant une intervention médicale1.
- Parmi les participants de l’étude VLA1553‑301, 361 (11,7 %) du groupe IXCHIQMC (n = 3082) ont signalé des effets indésirables semblables au chikungunya, dont 48 (1,6 %) présentaient des symptômes graves, tandis que 0,6 % des participants du groupe placebo (n = 1033) ont signalé des effets indésirables semblables au chikungunya, aucun n’étant grave.
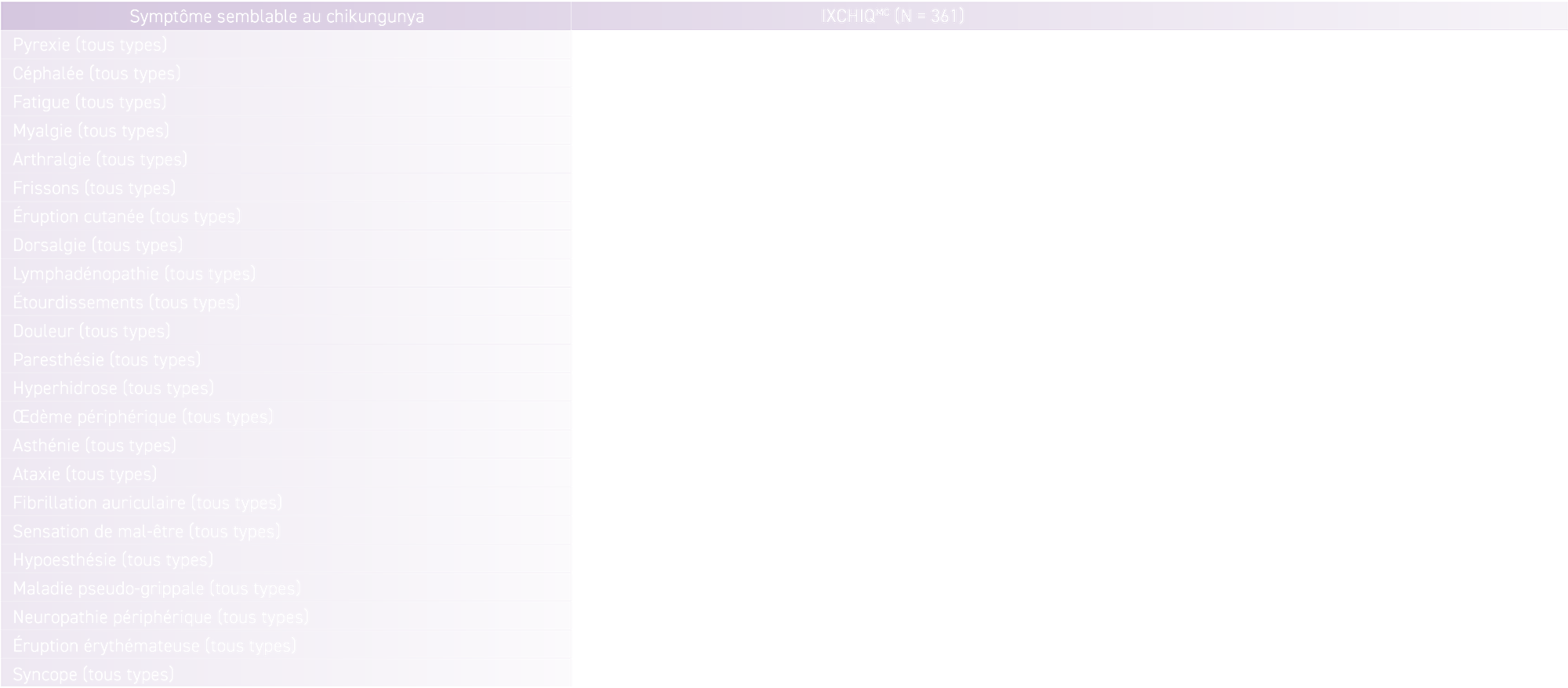

- Le délai médian d’apparition des effets indésirables semblables au chikungunya chez les receveurs d’IXCHIQMC était de 3,0 jours (fourchette de 0 à 10 jours) après la vaccination. La durée médiane des symptômes semblables au chikungunya chez les receveurs d’IXCHIQMC était de 4,0 jours (fourchette de 1 jour à au moins 6 mois) après la vaccination1.
- Vingt-deux receveurs d’IXCHIQMC ont présenté des effets indésirables prolongés semblables au chikungunya ayant duré plus de 14 jours (durée médiane de 33 jours, fourchette de 15 jours à au moins 6 mois). Quinze receveurs d’IXCHIQMC ont présenté des effets indésirables semblables au chikungunya ayant duré plus de 28 jours (durée médiane de 94 jours, fourchette de 29 jours à au moins 6 mois)1.
Effets indésirables graves
- La proportion de participants ayant signalé au moins un effet indésirable grave dans les 6 mois suivant l’administration d’IXCHIQMC était de 1,5 % (46/3082) dans le groupe IXCHIQMC et de 0,8 % (8/1033) dans le groupe placebo. Dans l’ensemble, 2 effets indésirables graves (2/3082 [0,1 %]) nécessitant une hospitalisation ont été considérés comme liés à IXCHIQMC : 1 cas de myalgie et 1 cas d’hyponatrémie hypovolémique et de fibrillation auriculaire; les deux cas se sont complètement rétablis. Aucun événement indésirable grave n’a été signalé dans le groupe placebo.
Décès et événements indésirables ayant entraîné le retrait de participants
- Trois participants sont décédés au cours de l’étude VLA1553‑301 en raison d’événements indépendants de l’étude (maladie coronarienne, COVID‑19 et lésion cérébrale anoxique). Aucun de ces décès n’a été considéré comme lié à IXCHIQMC. Environ 0,1 % des participants ayant reçu IXCHIQMC contre 0,2 % dans le groupe placebo ont interrompu leur participation à l’étude en raison d’événements indésirables.
Pour obtenir plus de renseignements sur les réactions indésirables survenues pendant les études cliniques, veuillez consulter la monographie d’IXCHIQMC.
