RÉSULTATS CLINIQUES : PLAN DE L’ÉTUDE
LE PROFIL D’EFFICACITÉ D’IXCHIQMC A ÉTÉ ÉVALUÉ DANS LE CADRE D’UNE ÉTUDE DE PHASE III RANDOMISÉE, MENÉE À DOUBLE INSU ET CONTRÔLÉE PAR PLACEBO1,25
Phase III : Étude pivot multicentrique, randomisée, contrôlée par placebo et menée à double insu1,25*
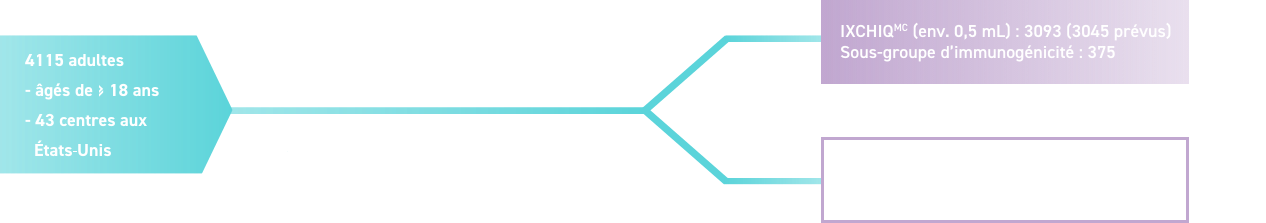
Le recrutement a été stratifié par groupes d’âge (18 à 64 ans et 65 ans ou plus)
Critère principal d’immunogénicité1,25
La réponse sérologique a été désignée comme critère d'immunogénicité de substitution pour l'efficacité†
- Définie comme l’obtention d’un titre d’anticorps neutralisant le virus μPRNT50 ≥ 150, qui a été considéré comme prédictif d’un bénéfice clinique, 28 jours après la vaccination chez des participants qui étaient séronégatifs au début de l’étude
Critère secondaire d’immunogénicité1,25
La réponse immunitaire mesurée par les titres d’anticorps neutralisants spécifiques du virus du chikungunya aux jours 8, 29, 85 et 6 mois après la vaccination, déterminés par le test μPRNT.
* Étude à double insu, randomisée et contrôlée par placebo menée auprès de 4115 adultes (1864 hommes et 2251 femmes) âgés de 18 à 94 ans. Les participants à l’étude ont reçu soit IXCHIQMC à 1×10E4 TCID50 par 0,5 mL, soit un placebo (solution saline tamponnée au phosphate) par injection intramusculaire à dose unique, et ont été suivis pendant 6 mois. Les participants étaient des hommes et des femmes adultes en santé, sans infection au virus du chikungunya connue ou suspectée et peu susceptibles d’être exposés à ce virus au cours de l’étude. Les sujets atteints de maladies chroniques ou de pathologies stables et bien contrôlées par un traitement au cours des six derniers mois étaient admissibles pour participer à l’étude clinique. Les sujets immunodéprimés ne pouvaient pas participer à l’étude clinique.
† Ceci est basé sur des données non cliniques provenant d'une étude pharmacologique sur des primates non humains montrant que les animaux traités avec des sérums immunisés provenant d'échantillons cliniques collectés dans l'étude VLA1553-101 ont été protégés contre la maladie CHIKV légère provoquée par une souche de type sauvage du CHIKV. Un niveau de titre d'anticorps neutralisants d'environ 150 avant le test de provocation a entraîné une absence de détection du virus pendant les 14 jours suivant le test de provocation.
CRITÈRE PRINCIPAL D’IMMUNOGÉNICITÉ
Taux de réponse sérologique élevés démontrés dans une étude pivot1,25*
IXCHIQMC a généré un taux de réponse sérologique de 98,9 % des participants, 28 jours après une dose unique1,25†‡
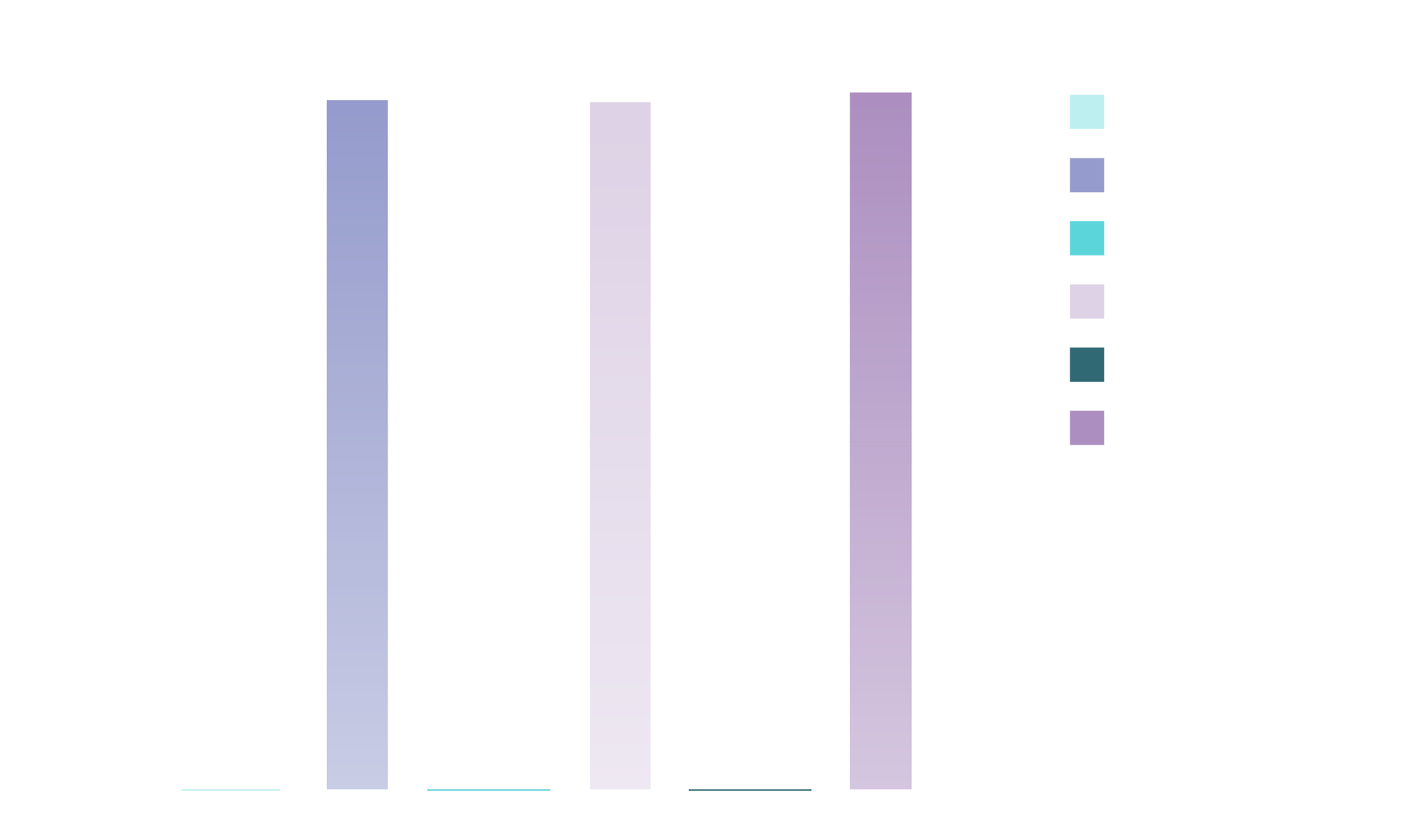
D’après la monographie d’IXCHIQMC et Schneider et al1,25.
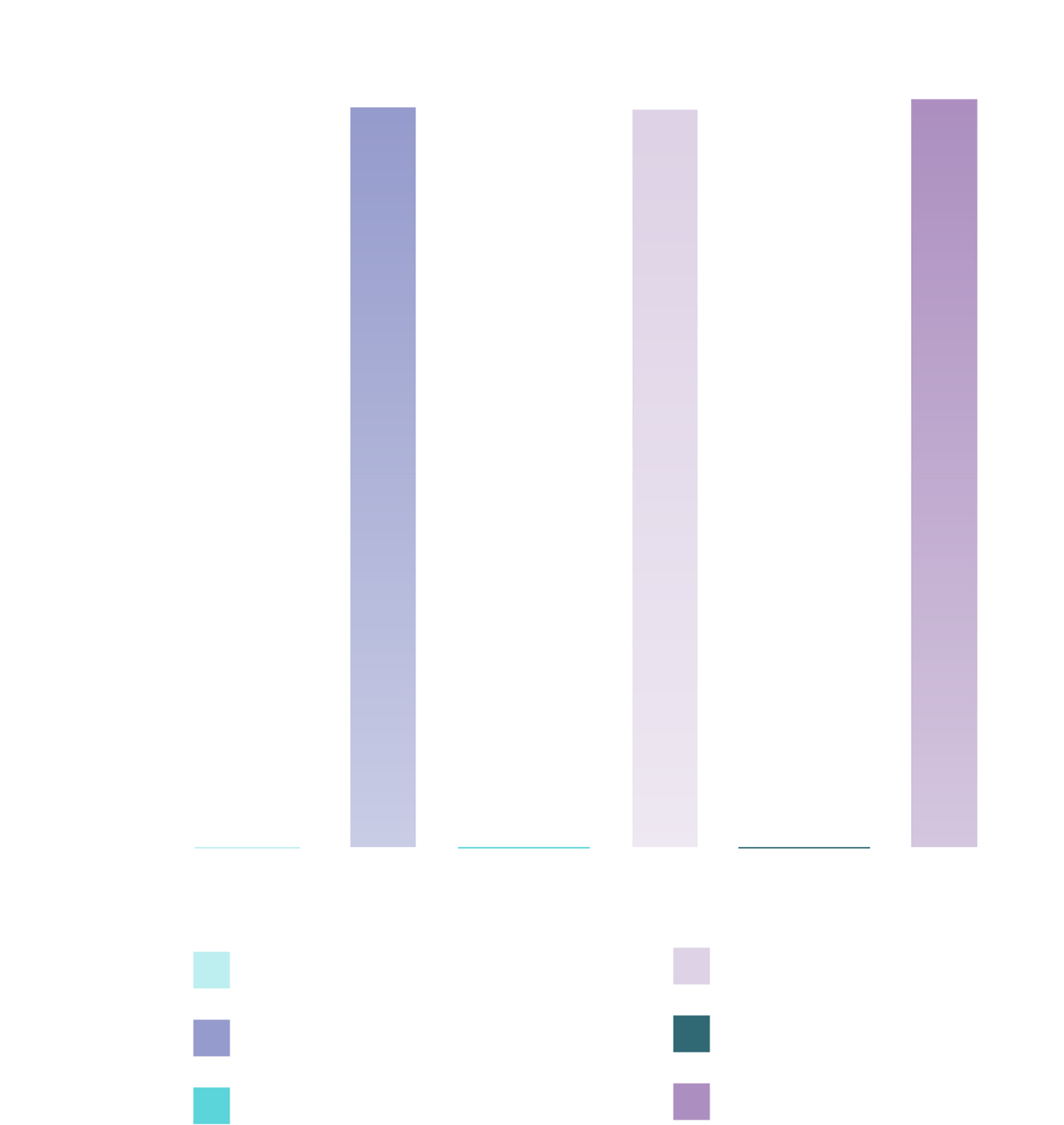
Des taux de réponse sérologique élevés ont été observés 28 jours après la vaccination et se sont maintenus 180 jours après la vaccination1,25‡
28 jours après la vaccination
(p < 0,0001; IC à 95 % : 96,7–99,8)
180 jours après la vaccination
(IC à 95 % : 93,1–98,3)
*Pourcentage de participants présentant des titres d’anticorps neutralisants supérieurs au seuil de ≥ 150, déterminés par le test μPRNT50.
†Critère de réussite : limite inférieure de l'intervalle de confiance à 95 % pour le taux de réponse sérologique > 70 %.
‡La portée clinique n’a pas été établie.
IC :intervalle de confiance; μPRNT : test de neutralisation de la réduction des microplaques.
CRITÈRE SECONDAIRE D’IMMUNOGÉNICITÉ
Moyenne géométrique des titres (MGT) des anticorps neutralisants spécifiques du virus du chikungunya 28 jours et 6 mois après la vaccination (population PP)1*†‡
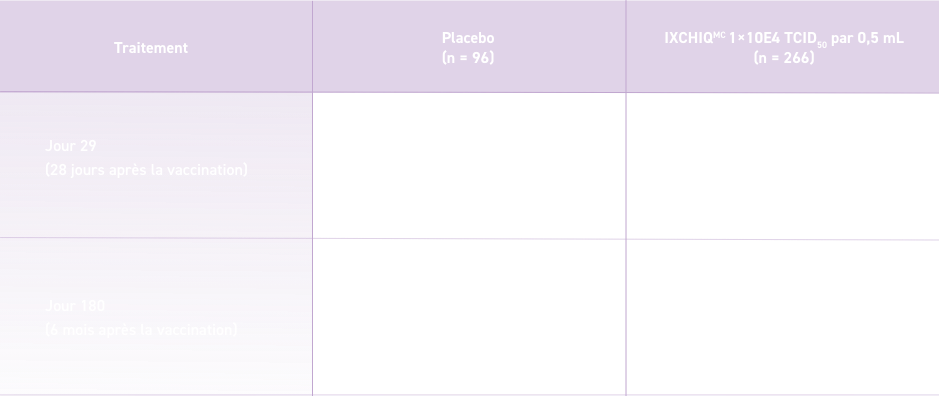
D’après la monographie d’IXCHIQMC1.
* Étude à double insu, randomisée et contrôlée par placebo menée auprès de 4115 adultes (1864 hommes et 2251 femmes) âgés de 18 à 94 ans. Les participants à l’étude ont reçu soit IXCHIQMC à 1×10E4 TCID50 par 0,5 mL, soit un placebo (solution saline tamponnée au phosphate) par injection intramusculaire à dose unique, et ont été suivis pendant 6 mois. Les participants étaient des hommes et des femmes adultes en santé, sans infection au virus du chikungunya connue ou suspectée et peu susceptibles d’être exposés à ce virus au cours de l’étude. Les sujets atteints de maladies chroniques ou de pathologies stables et bien contrôlées par un traitement au cours des six derniers mois étaient admissibles pour participer à l’étude clinique. Les sujets immunodéprimés ne pouvaient pas participer à l’étude clinique.
† Déterminée par le test μPRNT.
‡ La portée clinique n’a pas été établie.
IC : intervalle de confiance; MGT : moyenne géométrique des titres; PP : par protocole; TCID50 : dose infectant 50 % des cultures cellulaires; μPRNT : test de neutralisation de la réduction des microplaques.
